Bourses de thèses: concours CBS2 ouvert jusqu'au 23 avril



Le premier rendez-vous réunissant doctorants et post-doctorants du CBS aura lieu le lundi 5 juillet 2021 via Zoom ! Cette journée permettra à l’ensemble des jeunes chercheurs non-permanents du laboratoire de se rencontrer, présenter leur sujet de recherche, et échanger librement autour des thématiques proposées ce jour. De plus, deux invités spéciaux conviés à cette réunion auront l’occasion de présenter leur parcours post-études. Étant tous deux des anciens étudiants du CBS et ayant orienté leurs recherches vers l’académique ou le privé, la présentation de ces différents parcours permettra d’éclaircir le devenir des jeunes chercheurs de passage au CBS.


Les candidatures de Master sont ouvertes jusqu'au 6 juin 2022.
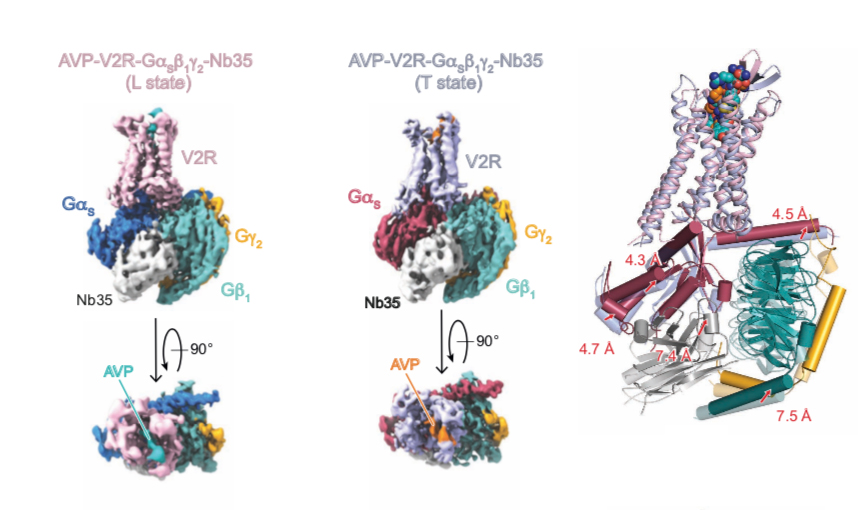

L'arginine vasopressine (AVP) est l'hormone antidiurétique qui régule une fonction vitale de notre organisme, l'équilibre hydrique. Elle agit au niveau du rein, plus précisément à la membrane plasmique des cellules principales du tubule collecteur, segment distal du néphron. C'est par son interaction avec le récepteur V2 (V2R), protéine membranaire de la famille des récepteurs couplés aux protéines G (RCPGs), que cette hormone peptidique active une voie de signalisation cellulaire qui conduit à une relocalisation des canaux à eau, les aquaporines, et donc à la réabsorption de l'eau de l'urine vers le sang. Le couplage du récepteur V2 à la protéine Gs constitue une étape clé de cette voie de signalisation.
L'équipe Biologie Structurale Multi-Echelle en collaboration avec l'équipe de Bernard Mouillac et Sébastien Granier de l'IGF, a déterminé la structure du complexe de signalisation V2R : AVP : Gs par cryo-microscopie électronique en particule isolées en combinant la carte de densité électronique obtenue avec des données de RMN (résonance magnétique nucléaire) déterminées par Hélène Déméné (Equipe « Structure et Dynamique d'assemblages Membranaires », CBS) et des approches computationnelles de dynamique moléculaire développées par Nicolas Floquet à l'Institut des Biomolécules Max Mousseron (IBMM).
Cette étude révèle la dynamique extrêmement forte du complexe V2R : AVP : Gs puisque que trois états conformationnels ont été observés reflétant des modes d'interaction de l'AVP et de la protéine Gs différents. Ces structures permettent de comprendre en quoi certaines mutations induisent deux maladies génétiques, le diabète insipide néphrogénique congénital et le syndrome néphrogénique d'antidiurèse inappropriée.
Cette étude ouvre la voie au développement de nouvelles molécules thérapeutiques pour activer ou bloquer le récepteur V2. Cette perspective de recherche est cruciale vis-à-vis de maladies difficiles à gérer et accablantes pour les patients.
Accès article : https://advances.sciencemag.org/content/7/21/eabg5628
Cryo-electron microscopy structure of the antidiuretic hormone arginine-vasopressin V2 receptor signaling complex.
J. Bous, H. Orcel, N. Floquet, C. Leyrat, J. Lai-Kee-Him, G. Gaibelet, A. Ancelin, J. Saint-Paul, S. Trapani, M. Louet, R. Sounier, H. Déméné, S. Granier*, P. Bron*, B. Mouillac*. Science Advances, 7, eabg5628 (2021).
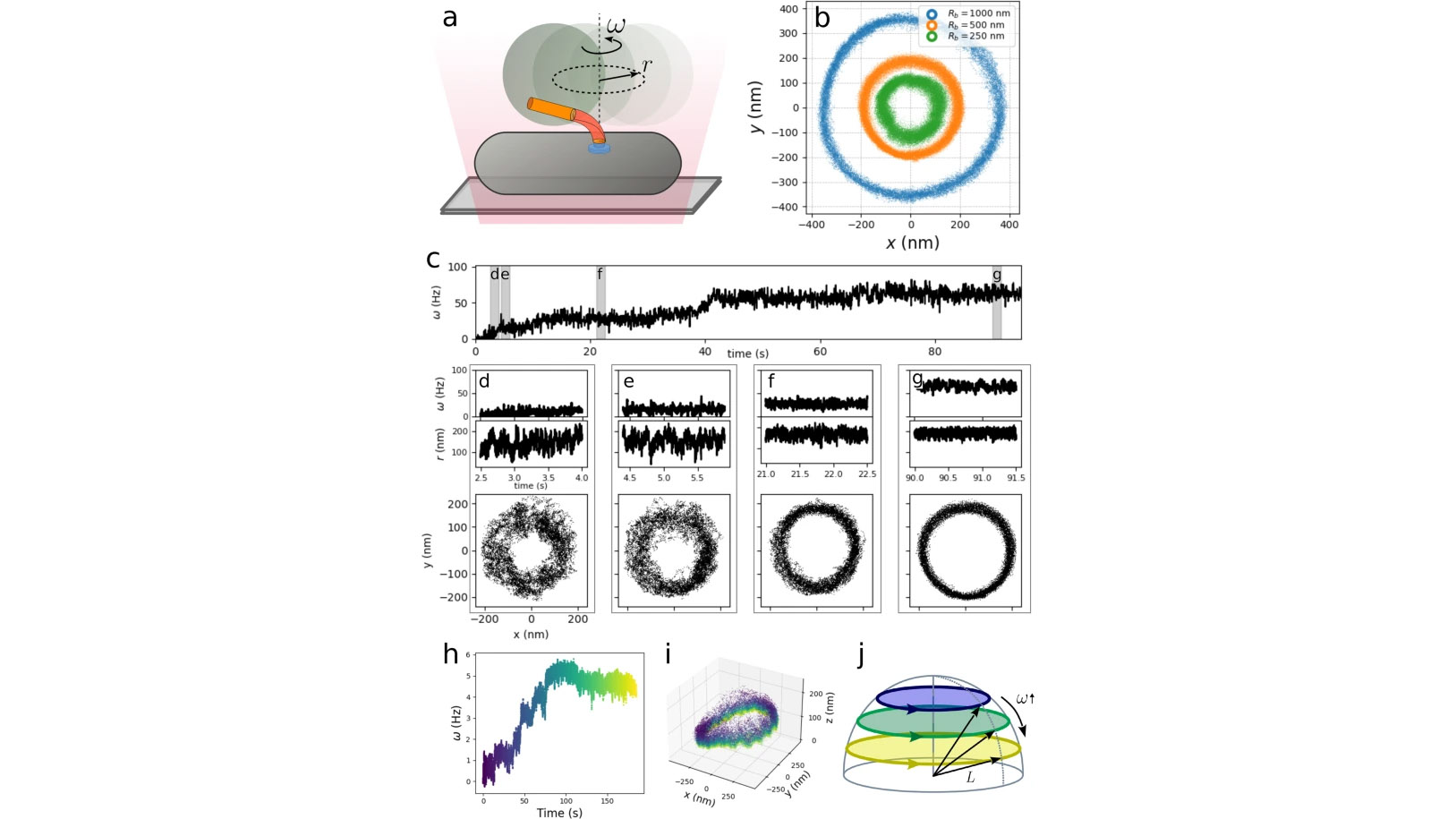
Pour de nombreuses bactéries, la motilité provient d'un ou plusieurs flagelles, chacun mis en rotation par le moteur flagellaire bactérien, une puissante machine moléculaire rotative. Le crochet, un polymère souple à la base de chaque flagelle, agit comme un joint universel, couplant la rotation entre le rotor rigide traversant la membrane et le flagelle rigide. Chez les espèces multiflagellées, où la poussée provient d'un faisceau flagellaire coordonné de manière hydrodynamique, la flexibilité du crochet est cruciale, car les flagelles tournent de manière significative hors de l'axe. Cependant, par conséquent, la poussée applique un moment fléchissant important. Par conséquent, le crochet doit être à la fois souple pour permettre la formation du faisceau et rigide pour résister à des forces hydrodynamiques importantes. Ici, via des mesures à haute résolution et une analyse des fluctuations du crochet dans des conditions dynamiques, nous élucidons comment il remplit cette double fonctionnalité : le crochet montre une augmentation dynamique de la rigidité en flexion sous une contrainte de torsion croissante. Un tel renforcement de la contrainte permet au système d'être flexible en cas de besoin tout en réduisant la déformation sous des charges élevées, permettant une motilité à grande vitesse.
Texte intégral: https://www.nature.com/articles/s41467-022-30295-7
