Reconnaissance hôte-pathogène par le modèle du leurre intégré
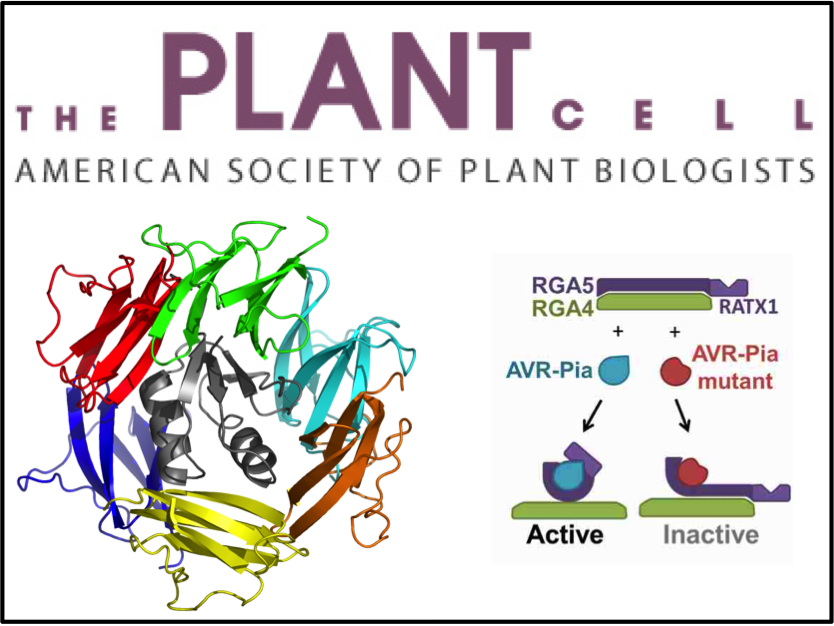
La réponse immunitaire chez les plantes est largement arbitrée par les protéines multidomaines NLR. Ces récepteurs immunitaires sont les éléments clés de la reconnaissance du pathogène conduisant à la susceptibilité ou à la résistance des plantes. Nos collaborateurs au BGPI (Biologie et Génétique des Interactions Plantes-Parasites) du centre Inra de Montpellier s'intéressent aux interactions entre le riz et le champignon phytopathogène Magnaporthe oryzae. Le riz constitue la principale source de nourriture pour la moitié de la population mondiale, et la durabilité des cultures représente un enjeu majeur de santé publique. Depuis plusieurs années, l'équipe « Structure, Dynamique et Fonction des biomolécules par RMN » du CBS a entrepris une collaboration pour mieux comprendre les mécanismes moléculaires mis en jeu lors de la reconnaissance hôte-pathogène. Une approche par résonnance magnétique nucléaire ainsi que des tests d'interactions protéines–protéines réalisées in vitro et in vivo ont permis de proposer un modèle expliquant le processus de reconnaissance qui implique notamment le domaine de leurre intégré au récepteur. Ce modèle suggère que les effecteurs du champignon (protéines agissant comme des facteurs de virulence) sont reconnus par le domaine de leurre intégré mais que cette reconnaissance exige aussi une synergie avec les autres domaines du récepteur immunitaire.