La cryo-tomographie électronique révèle l'organisation structurale in cellulo du complexe de réplication du virus Chikungunya
La cryo-tomographie électronique et les techniques de moyennage des sous-tomogrammes révèlent l'organisation structurale in cellulo du complexe de réplication du virus Chikungunya au sein de la membrane plasmique.
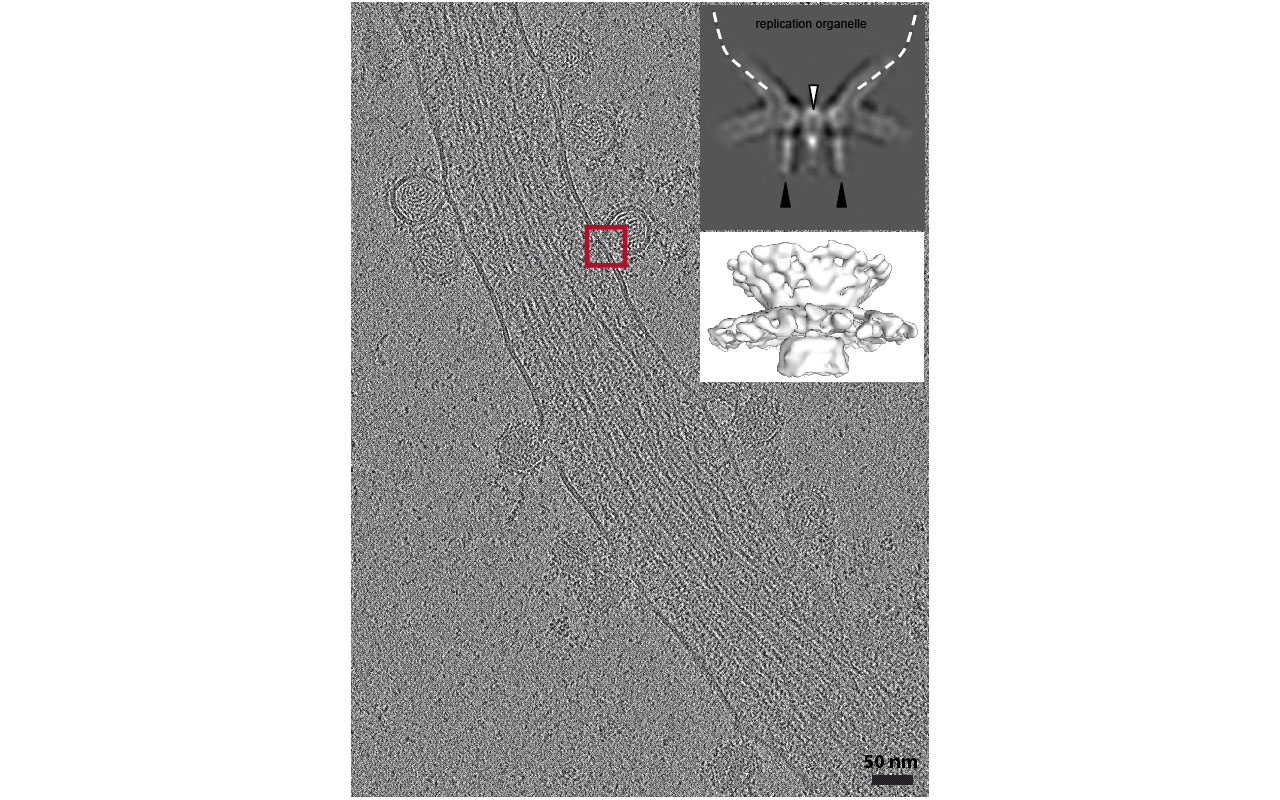
Le virus Chikungunya (CHIKV) est un pathogène transmis par les moustiques, responsable d'une maladie musculo-squelettique aiguë chez l'homme. La réplication du génome de l'ARN viral se produit dans des organites de réplication membranaires spécialisés, aussi appelés sphérules, contenant le complexe de réplication viral. Ce complexe membranaire comprend 4 protéines virales (nsP1-4) ainsi que des partenaires cellulaires. Par une approche combinée de cryo-tomographie électronique sur des cellules humaines infectées à 17 heures post-infection, de moyennage de sous-volumes et de cryo-coupe par CEMOVIS, nous étudions l’organisation structurale du complexe de réplication dans des cellules infectées ainsi que la dynamique de réplication au sein des sphérules. Ensemble, cette étude apporte un nouvel éclairage sur le comportement dynamique des organites de réplication de CHIKV et la réplication virale associée à l'interface avec les membranes cellulaires dans les cellules infectées.
Lien vers la publication
In situ fate of Chikungunya virus replication organelles
Justine Girard, Olivier Le Bihan, Joséphine Lai-Kee-Him, Maria Girleanu, Eric Bernard, Cedric Castellarin, Matthew Chee, Aymeric Neyret, Danièle Spehner, Xavier Holy, Anne-Laure Favier, Laurence Briant and Patrick Bron
J Virol. 2024 Jun 28:e0036824.doi: 10.1128/jvi.00368-24
Le Centre de Biologie Structurale (CBS) de Montpellier s’engage à accueillir 6 stagiaires de seconde générale et technologique, du 16 au 27 juin 2025
STAGES de SECONDE
Le Centre de Biologie Structurale (CBS) de Montpellier s’engage à accueillir 6 stagiaires de seconde générale et technologique, du 16 au 27 juin 2025.
Durant les 2 semaines passées au laboratoire, les stagiaires répartis en binômes alterneront entre des ateliers de découverte dans différentes disciplines (biologie moléculaire et cellulaire, biochimie, microscopie, biophysique…) et des journées d’observation auprès du personnel exerçant différents métiers de la recherche. A l’issue du stage, les élèves devront réaliser et présenter un poster en lien avec l’une des thématiques scientifiques abordées lors du stage.
Ces stages s’adressent en priorité à des élèves de seconde, s'engageant dans des spécialités scientifiques en première et terminale. Les demandes doivent etre adressées exclusivement via le formulaire:
https://docs.google.com/forms/d/e/1FAIpQLSeZOCBlIV1QPZcAa-5NFVG7PI5CcAEY2cFENcIItx1lbKwvzw/viewform?usp=sf_link
En complément, un CV et une lettre de motivation devront être envoyés à l'adresse Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser. avant le 7 mars 2025 (fichier pdf unique au nom du candidat). Une sélection sera effectuée sur la base de ce dossier. Nous serons aussi particulièrement attentifs à la parité et une liste d’attente sera établie pour pallier tout désistement. Les réponses seront données aux élèves le 14 mars 2025
Il est recommandé de rechercher un autre stage dans l’éventualité où votre candidature ne serait pas retenue.









