Origami ADN pour explorer la mécanotransduction cellulaire
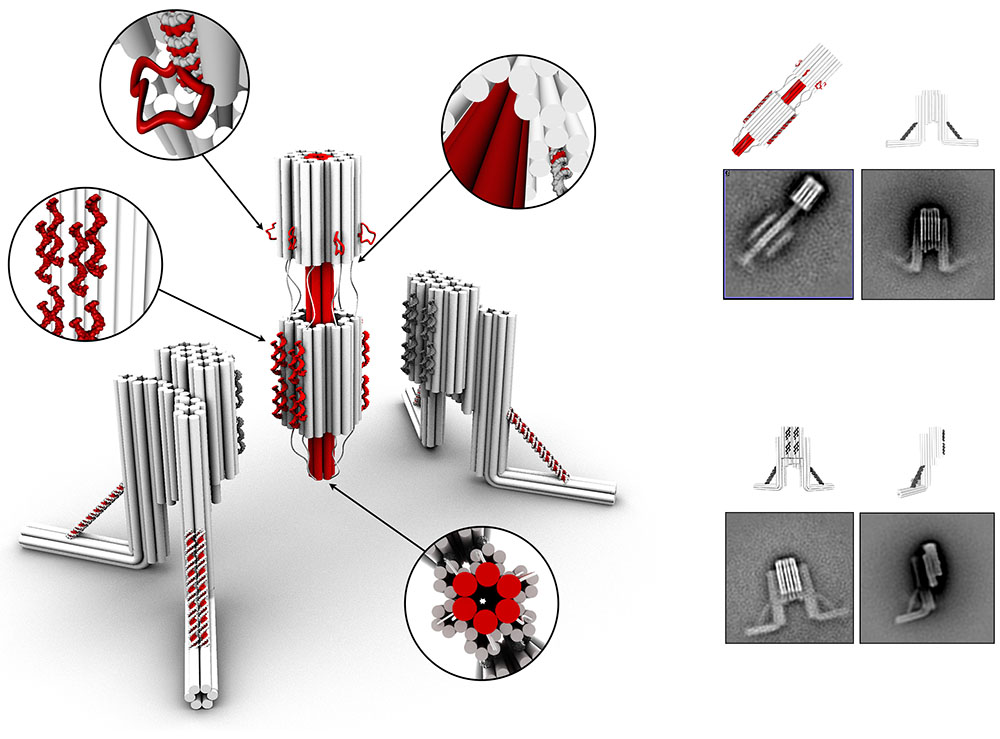
Les cellules et les tissus biologiques répondent aux stimuli mécaniques exercés par leur environnement en les convertissant en signaux biologiques. Cependant, notre compréhension de la mécanotransduction est souvent entravée par des barrières techniques, y compris des limitations dans notre capacité à appliquer efficacement des forces de l’ordre du piconewton dirigées sur des mécanorécepteurs spécifiques sur les membranes cellulaires sans essais laborieux et répétitifs. Pour surmonter ces défis, nous avons conçu une nanostructure appelée « Nano-Winch », un actionneur moléculaire à base d'origami d'ADN robuste, facile à assembler et programmable. Le « Nano-Winch » est conçu pour manipuler plusieurs mécanorécepteurs en parallèle en exerçant des forces de l’ordre du piconewton dans deux modes. Un mode autonome et un mode activé à distance via des liaisons d'ADN simple et double brin réglables, respectivement. Les « Nano-Winch » en mode autonome peuvent fonctionner sur la surface de la cellule. Le ciblage de ce dispositif sur les récepteurs intégrines a permis de stimuler la phosphorylation détectable en aval de la kinase d'adhérence focale « FAK », une indication que les « Nano-Winch » peuvent être appliqués pour étudier les processus mécaniques cellulaires. Le mode d'activation à distance permet un contrôle d'extension plus fin et avec des forces plus importantes. En utilisant ce second mode d’activation, nous avons pu observer directement l'ouverture d'un canal membranaire sensible aux forces extérieures, la protéine BtuB. Cet origami personnalisable fournit une approche sans instrument qui pourrait être appliquée pour contrôler et explorer une diversité de circuits de mécanotransduction sur des cellules.
Full text : DOI: 10.1038/s41467-022-30745-2
INSERM presse : https://presse.inserm.fr/en/a-nano-robot-built-entirely-from-dna-to-explore-cell-processes/45568/
Youtube : https://www.youtube.com/watch?v=SNgbSNQx3g0
Journal LePoint : https://www.lepoint.fr/sante/medecine-un-nanorobot-qui-tripote-les-cellules-31-07-2022-2484929_40.php
Midi Libre : https://www.midilibre.fr/2022/07/28/montpellier-des-chercheurs-inventent-un-nanorobot-revolutionnaire-capable-dexplorer-une-cellule-humaine-10459462.php
Pousse-toi de là que je m'y mette ! Protéine G et bêta-arrestine entrent en compétition
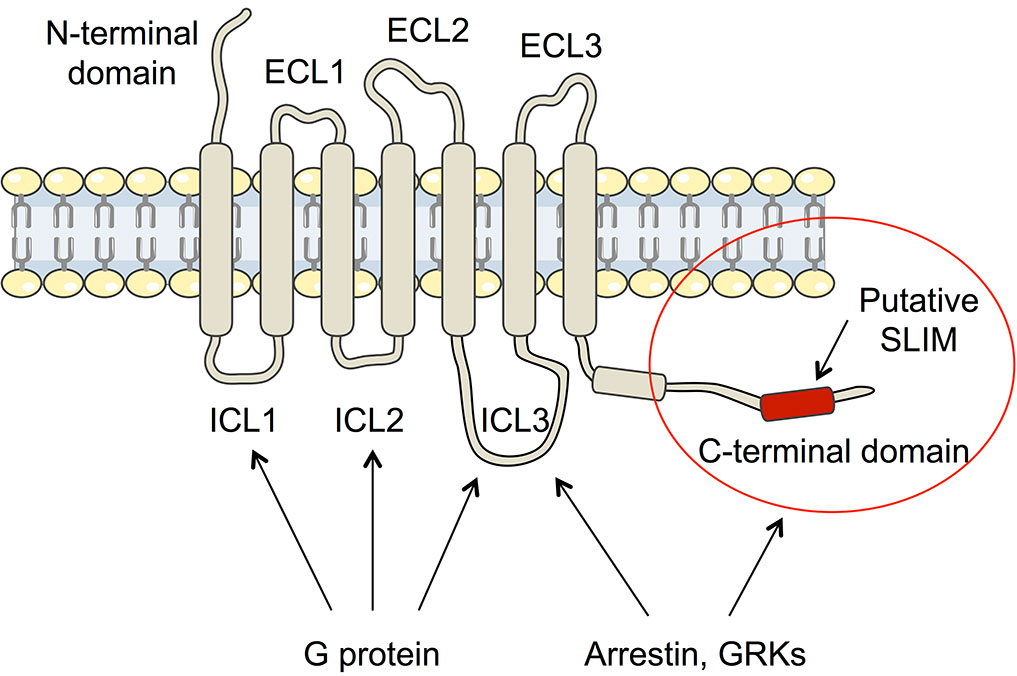
L’arginine vasopressine (AVP) est l’hormone antidiurétique qui régule une fonction vitale de notre organisme : l’équilibre hydrique. Elle agit au niveau du rein, plus précisément à la membrane plasmique des cellules principales du tube collecteur, segment distal du néphron. C’est par son interaction avec le récepteur V2 (V2R), protéine membranaire de la famille des récepteurs couplés aux protéines G (RCPGs), que cette hormone peptidique active une voie de signalisation cellulaire qui conduit à une relocalisation des canaux à eau, les aquaporines, et donc à la réabsorption de l’eau de l’urine vers le sang. Le couplage du récepteur V2 à la protéine Gs constitue une étape clé de cette voie de signalisation. Mais ce n’est pas tout. Le récepteur n’est pas « fidèle » à la protéine G car il interagit également avec les ß-arrestines qui provoquent son internalisation/désensibilisation puis activent d’autres voies de signalisation impliquées en particulier au cours de la croissance et la différentiation cellulaire. Les deux partenaires canoniques de signalisation sont les deux facettes d’une régulation efficace de la fonction antidiurétique.
Alors, comment le récepteur V2 « choisit-il » entre la protéine G et la ß-arrestine ? Un vrai dilemme Cornélien... Il y a un intérêt tout particulier à répondre à cette question puisque le développement de ligands du V2R sélectifs d’une voie ou d’une autre (ligands biaisés) présente un intérêt important pour améliorer l’efficacité des futures molécules thérapeutiques, tout en diminuant leurs effets indésirables.
Après avoir réussi à résoudre la structure du récepteur V2 en complexe avec l’AVP et la protéine Gs, l’équipe de Bernard Mouillac et Sébastien Granier à l’Institut de Génomique Fonctionnelle (IGF), en collaboration avec l’équipe de Patrick Bron au Centre de de Biologie Structurale (CBS) vient de déterminer la structure tridimensionnelle (3D) du V2R complexé à l’hormone naturelle AVP et à la ß-arrestine1 par une approche de cryo-microscopie électronique (lien publication). C’est donc un travail 100% montpelliérain mais aussi une première française. Aujourd’hui, seules 5 structures de complexes de signalisation d’un RCPG couplé à une arrestine ont été décrites: celles impliquant la rhodopsine, le récepteur ß1-adrénergique, le récepteur M2 muscarinique de l’acétylcholine, le récepteur NTSR1 de la neurotensine et donc le récepteur V2 de l’AVP.
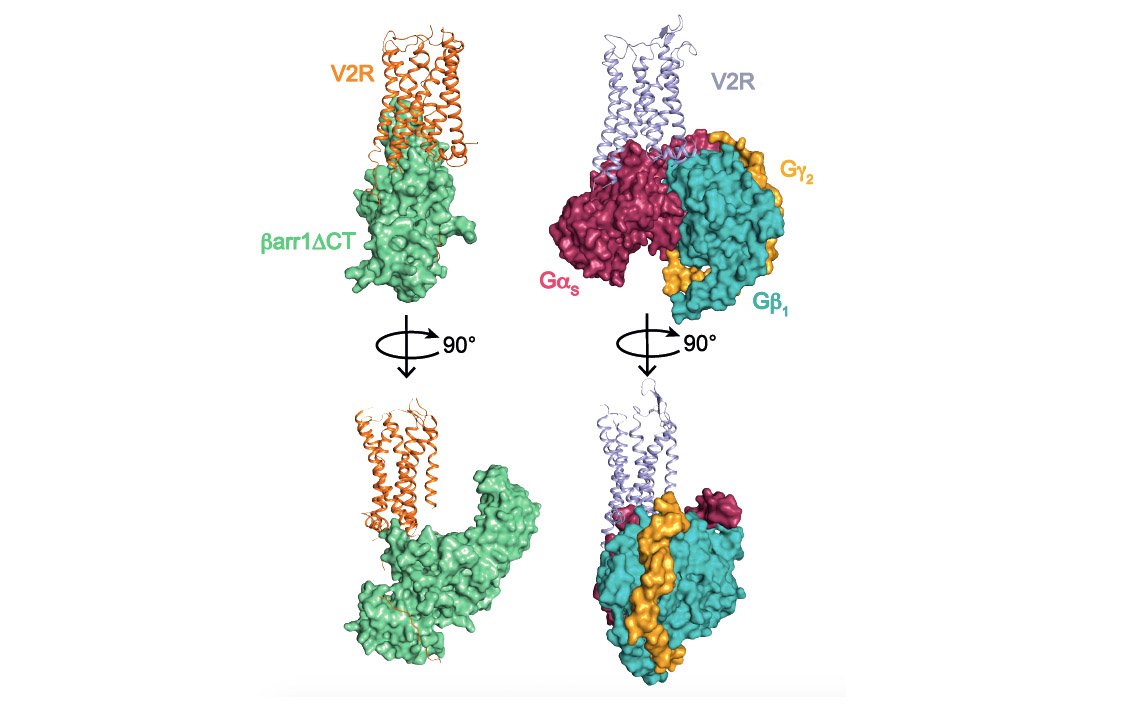
Cette approche de biologie structurale combinée à des approches de pharmacologie moléculaire et de modélisation/dynamique moléculaire, ont permis de déterminer l’architecture générale du complexe et en particulier de définir l’interface entre le récepteur et la ß-arrestine (voir figure associée). Plusieurs surprises ont été révélées. Tout d’abord, l’orientation de la ß-arrestine vis-à-vis du V2R est totalement atypique par rapport à celle des arrestines liées aux autres RCPGs. Ce positionnement met en avant le caractère très dynamique de ces complexes de signalisation et leur grande variabilité structurale malgré une conformation générale conservée. Ensuite, l’interface V2R-ß-arrestine1 est originale car elle implique tous les domaines intracellulaires du récepteur. C’est donc une combinaison spécifique de la conformation du V2R et de la ß-arrestine1 qui explique l’originalité de l’interaction. Enfin, la protéine Gs et la ß-arrestine1 interagissent avec la même « cavité » intracellulaire du V2R et sont donc compétitives l’une par rapport à l’autre vis-à-vis de ce site de liaison. La comparaison des deux structures (voir figure associée) permet de comprendre comment la ß-arrestine « arrête » le signal associé à la protéine G en prenant la place de celle-ci (pousse-toi de là que je m’y mette), phénomène à la base des processus d’internalisation et de désensibilisation du récepteur.
Le V2R est une cible thérapeutique majeure pour traiter les désordres du métabolisme de l’eau (hyponatrémie consécutive à une insuffisance cardiaque, hypertension, cirrhose du foie) et les troubles de la miction (incontinence). De plus, de nombreuses mutations du récepteur sont responsables de deux maladies génétiques rares présentant un tableau clinique inversé : 1/ le diabète insipide néphrogénique congénital (DINc) dû à des mutations « perte de fonction » associées à une incapacité des patients à concentrer leurs urines, 2/ le syndrome néphrogénique d’antidiurèse inappropriée (SNADI) lié à des mutations constitutivement actives caractérisé par une intoxication à l’eau et une hyponatrémie. Le V2R est également une cible primordiale pour traiter certaines formes de polykystose rénale, maladie beaucoup plus fréquente menant en général à une insuffisance rénale. A l’avenir, la connaissance complète des détails atomiques des différentes conformations du récepteur V2, aussi bien actives (en présence d’agonistes et des partenaires de signalisation) qu’inactives (en présence d’antagonistes) guidera le développement rationnel de nouvelles molécules thérapeutiques améliorées. Cette perspective de recherche est cruciale vis-à-vis de maladies difficiles à gérer et accablantes pour les patients.
Lien publication : Structure of the vasopressin hormone-V2 receptor-b-arrestin1 ternary complex.
J. Bous#, A. Fouillen#, H. Orcel, S. Trapani, X. Cong, S. Fontanel, J. Saint-Paul, J. Lai-Kee-Him, S. Urbach, N. Sibille, R. Sounier, S. Granier*, B. Mouillac*, P. Bron*.

Comparaison des complexes de signalisation du récepteur V2 impliquant la ß-arrestine1 (à gauche) et la protéine Gs (à droite). Les trois sous-unités a, b et g de la protéine G sont représentées. Une version tronquée (barr1DCT) de la ß-arrestine1 a été utilisée dans cette étude.