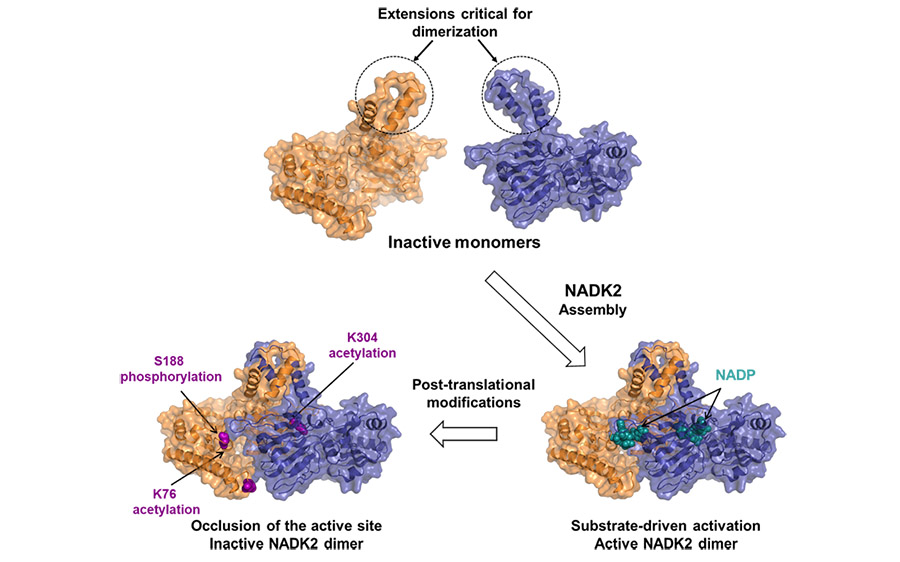
Les NAD+ kinases (NADK) sont des enzymes métaboliques qui phosphorylent le NAD+ pour produire le NADP+, un substrat limitant pour la génération de NADPH au pouvoir réducteur. La NADK2 est responsable de la production du NADPH mitochondrial qui permet la biosynthèse de proline et la défense contre le stress oxydatif. Cependant, son architecture moléculaire et son mécanisme de régulation restent non décrits. Ici, nous rapportons la structure cristallographique de la NADK2 humaine, révélant un mode d'activation piloté par le substrat. Nous constatons que la NADK2 présente une organisation en dimère inattendue au lieu de l'assemblage typique en tétramère observé pour les autres NADK. Un segment étendu spécifique (aa 325–365) est crucial pour la dimérisation et l'activité de la NADK2. De plus, nous caractérisons de nombreux événements d'acétylation, y compris ceux sur les Lys76 et Lys304, qui résident près du site actif, et inhibent l'activité de la NADK2 sans perturber la dimérisation, réduisant ainsi la production mitochondriale de NADP(H), la synthèse de proline et la croissance cellulaire. Ces découvertes révèlent des informations moléculaires importantes sur la structure et la régulation d'une enzyme vitale dans le métabolisme mitochondrial du NADPH et de la proline.
Charline Mary, Mona Hoseini Soflaee, Rushendhiran Kesavan, Muriel Gelin, Harrison Brown, Lauren G. Zacharias, Thomas P. Mathews, Andrew Lemoff, Corinne Lionne, Gilles Labesse* and Gerta Hoxhaj*
Texte Complet : https://doi.org/10.1016/j.molcel.2022.06.026

