Lien vers la publication: https://www.nature.com/articles/s41594-023-00920-0
La maladie de Huntington (MH) est une maladie neurodégénérative mortelle causée par une expansion des codons CAG dans le premier exon du gène HTT qui, après traduction, donne une un fragment poly-glutamine (poly-Q) étendu dans la région N-terminale de la protéine huntingtine (httex1). Seules les personnes ayant plus de 35 glutamines consécutives dans cette region développent la MH. Les changements structurels qui interviennent dans la protéine httex1 lorsque sa longueur dépasse ce seuil pathologique restent mal connus, ce qui empêche de comprendre les bases structurelles de la pathologie. L'étude structurale à haute résolution de httex1 a été considérée comme impossible en raison de sa flexibilité intrinsèque, qui empêche l'utilisation de la cristallographie aux rayons X et de la cryo-microscopie électronique, et du fort biais de composition qui entrave l'utilisation des approches de Résonance Magnétique Nucléaire (RMN) traditionnelles. Au cours des dernières années, notre groupe a développé des approches de biologie chimique pour incorporer des acides aminés marqués isotopiquement dans les protéines de manière spécifique, ce qui permet d'étudier par RMN à haute résolution des protéines hautement répétitives, telles que httex1.
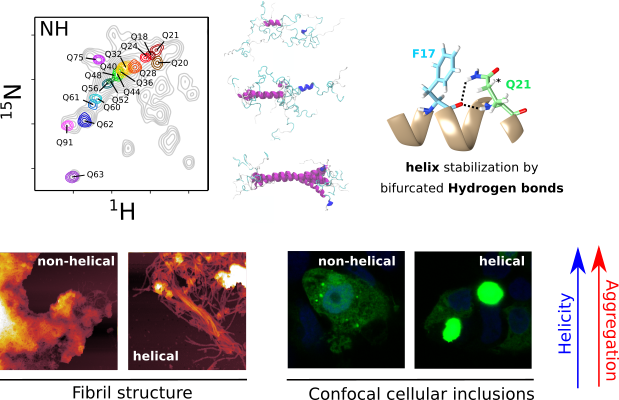
L'application systématique du marquage isotopique spécifique a permis la caractérisation structurelle par RMN des fragments poly-Q pour des versions pathogéniques (Q46 et Q66) de httex1. Ces données RMN ont été intégrées avec la diffusion de rayons-X a petits angles (SAXS) et méthodes computationnels, afin de dériver des modèles d'ensemble et de définir les règles régissant la structure du poly-Q. Notre analyse révèle que le poly-Q adopte de longues conformations α-hélicoïdales propagées et stabilisées par des liaisons hydrogène entre la chaîne latérale de la glutamine et le squelette, et met en évidence l'importance des régions flanquantes dans la définition de cette structure. D'un point de vue biomédical, nous montrons que la stabilité α-hélique est une signature plus forte que le nombre de glutamines pour définir la cinétique d'agrégation, à la fois in vitro et dans les cellules, et la structure des fibres qui en résultent. Nos observations fournissent une perspective structurelle de la pathogénicité de la httex1 élargie et ouvrent la voie à une compréhension plus approfondie des maladies liées à la poly-Q.