Le récepteur de la morphine dans tous ses états

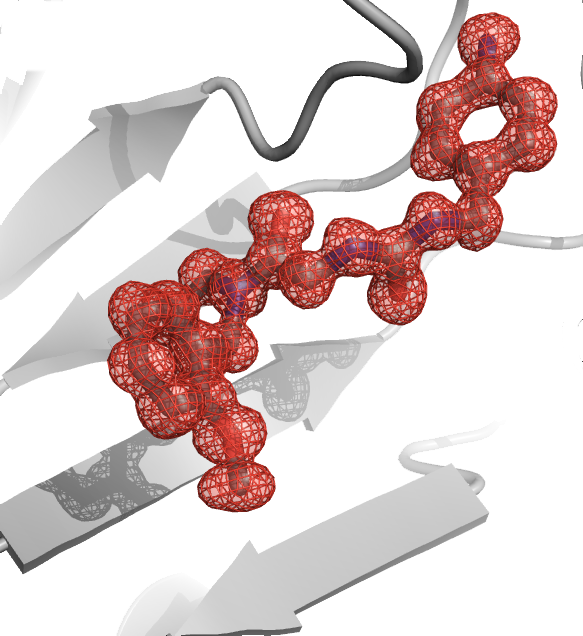
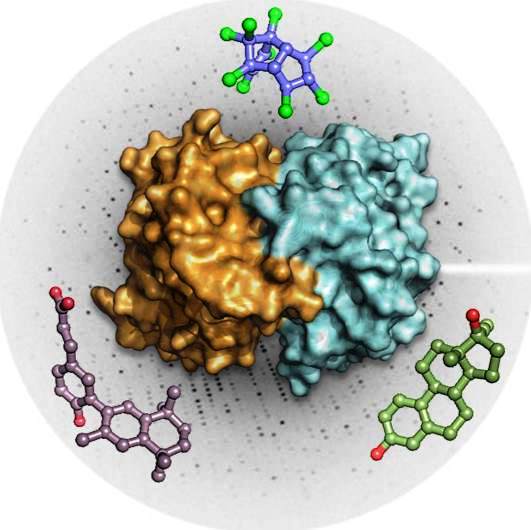
Une collaboration étroite entre l'équipe de Sébastien Granier (IGF) de Montpellier, Hélène Déméné (CBS, de l'équipe « RMN, Structure, Dynamique et Fonction des Biomolécules par RMN ») et l'équipe du Pr. Brian Kobilka de l'Université de Stanford, lauréat du prix Nobel de chimie en 2012, a permis de décrypter les mécanismes moléculaires de l'activation du récepteur de la morphine, appelé aussi récepteur mu opioïde (µOR) en utilisant des méthodes de pointes de biologie structurale associant la cristallographie aux rayons X et la Résonance Magnétique Nucléaire (RMN). Le récepteur de la morphine est une protéine membranaire de la famille des récepteurs couplés aux protéines G (RCPG) dont le mécanisme de fonctionnement est très peu connu. Ce manque de connaissance est notamment dû aux difficultés que rencontrent les chercheurs pour étudier ces protéines membranaires par des approches de biologie structurale. Cette étude a ainsi fait l'objet d'une publication dans la revue scientifique Nature (Sounier et al., Nature, 524(7565):375-8 -doi: 10.1038/nature14680).
L'étude RMN révèle comment la fixation d'un ligand qui mime la morphine (agoniste) induit des changements d'états conformationnels du µOR d'un état inactif vers un état actif le seul capable de conduire à la transduction du signal intracellulaire via l'activation des protéines de signalisations comme les protéines G. L'étude démontre aussi que cet état actif ne peut être atteint que si l'agoniste et la protéine G sont liés simultanément au récepteur. Cette propriété n'avait été précédemment observée que sur un seul des 800 membres qui composent la famille des RCPG. Ainsi, l'étude révèle comment le signal d'activation se propage à travers les différents domaines du récepteur et propose que ce processus joue un rôle clé dans la transduction du signal. De manière générale, ces données lèvent le voile sur le processus peu connu d'activation des RCPG et de sa dynamique.
Nouvelle publication: "Propagation of conformational changes during μ-opioid receptor activation"
Auteurs: Sounier R, Mas C, Steyaert J, Laeremans T, Manglik A, Huang W, Kobilka BK, Déméné H, Granier S.
Journal: Nature. 2015 Aug 20;524(7565):375-8. doi: 10.1038/nature14680.
Lien vers l'article