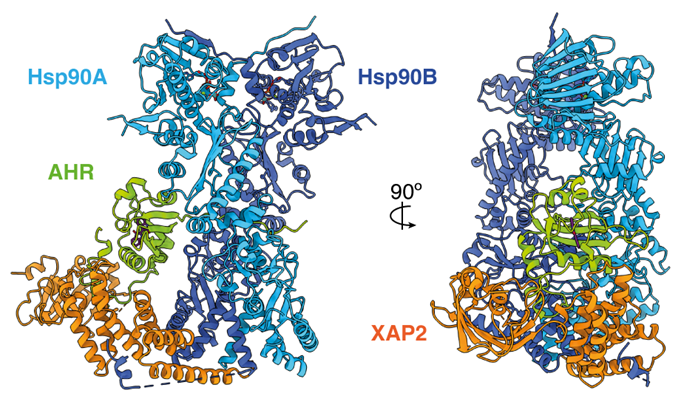
Les organismes vivants ont développé des capteurs protéiques qui les aident à s'adapter à leur environnement. Le récepteur des hydrocarbures aromatiques (AHR) est un membre emblématique de cette classe de protéines. AHR est un facteur de transcription ligand-dépendant qui intervient dans un large éventail de processus physiologiques et pathologiques en réponse à des centaines de substances chimiques ou naturelles. Notamment, AHR est historiquement connu comme le récepteur de nombreux polluants tels que la dioxine ou les PCBs dont il médie le métabolisme mais également les effets délétères. En revanche, de nombreux composants de l’alimentation ou leurs métabolites issus de notre microbiote intestinal ont été décrits comme des ligands d’AHR ayant des effets bénéfiques sur la santé. Des dérèglements du fonctionnement d’AHR sont impliqués dans l’apparition de diverses pathologies telles que des cancers ou des maladies inflammatoires chroniques de l’intestin. Jusqu’à aujourd’hui la grande instabilité de cette protéine et l'absence de données structurales à haute résolution qui en découle limitaient notre compréhension des mécanismes moléculaires par lesquels l’activité transcriptionnelle d’AHR peut être modulée par une telle diversité de composés. En utilisant la cryo-microscopie électronique, nous avons résolu la structure 3D d’un complexe fonctionnel comprenant AHR lié à l’un de ses ligands naturels, l’indirubine, la chaperonne Hsp90 et la co-chaperonne XAP2. La structure à une résolution de 2,8 Å révèle une action concertée de Hsp90 et XAP2 permettant de maintenir le récepteur dans une forme stable et fonctionnelle. Elle fournit surtout la première visualisation expérimentale du domaine de liaison du ligand d’AHR et révèle une organisation unique de la poche ou se fixent les petites molécules régulatrices. En dévoilant les déterminants moléculaires qui sous-tendent l’affinité, la spécificité et la diversité de liaison au récepteur, notre étude rationalise plus de quarante années de données biochimiques et apporte un éclairage nouveau sur le fonctionnement de ce récepteur important pour la régulation des interactions de l’hôte avec son environnement. En outre, ces informations à l’échelle atomique fournissent un cadre rationnel pour mieux comprendre l’impact des polluants environnementaux sur la santé humaine et la conception de médicaments ciblant AHR.
Accéder à l’article : https://rdcu.be/cZOTT