C. Lionne, M. Gelin, G. Labesse
Le but du groupe est d'aider à la conception de médicaments efficaces et spécifiques en étudiant les voies de réactions enzymatiques et les interactions médicament-cible par le biais de l'enzymologie fine, de la caractérisation biophysique et des approches thermodynamiques.
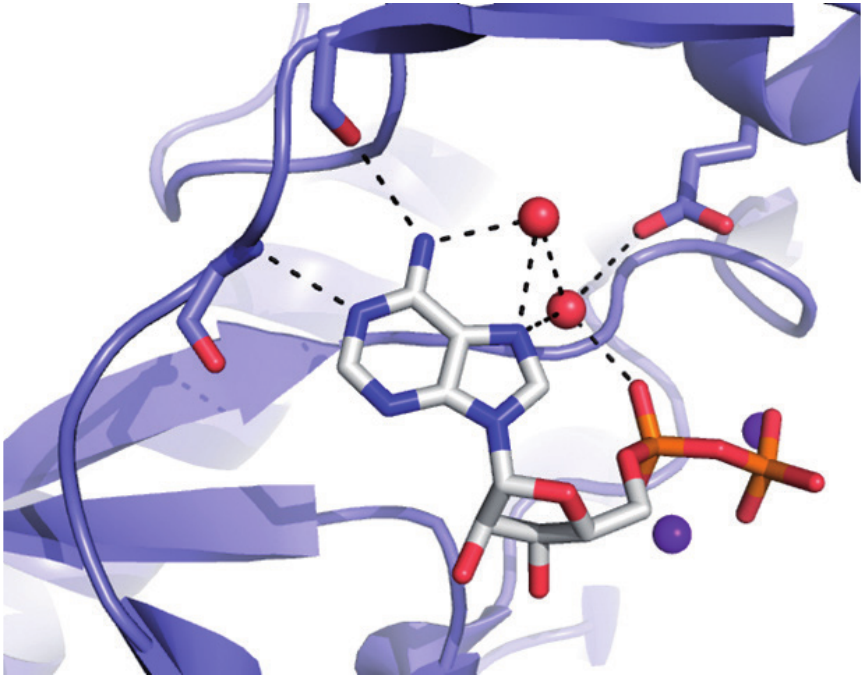
Des médicaments efficaces et spécifiques dirigés contre les enzymes sont beaucoup plus faciles à concevoir avec une compréhension profonde du fonctionnement des protéines, et surtout des états dans lesquels elles passent le plus clair de leur temps. Des techniques de cinétique transitoire (stopped-flow, quench-flow, cryoenzymologie) sont couramment utilisées pour mesurer la cinétique protéine-ligand (kon, koff), pour identifier la voie de réaction et les étapes limitant la vitesse, ainsi que pour caractériser les effets des inhibiteurs. En outre, d'autres techniques biophysiques sont utilisées pour caractériser les interactions médicament-cible: enzymologie classique à l'état d'équilibre, calorimétrie par titrage isotherme, décalage thermique, amarrage moléculaire et cristallographie aux rayons X. Des inhibiteurs optimisés sont conçus et leurs effets biologiques testés (en collaboration sur des modèles cellulaires et animaux). Le groupe concentre ses recherches sur de nouvelles cibles travaillant sur les nucléotides pour la conception de thérapies innovantes anti-infectieuses ou anticancéreuses.
Collaborations: S. Pochet (I. Pasteur), P.A. Kaminsli (I. Pasteur), O. Dussurget (I. Pasteur), L. Chaloin (CNRS), R. Candau (UM), E. Serpersu (Univ. Tennessee), S. Kunzelmann (Crick Inst.).
Références: Leban et al. Biochim Biophys Acta 2017; Kaplan et al. Biochim Biophys Acta 2016; Marton et al. J Med Chem 2015; Py et al. J Physiol 2015, Gráczer et al. FEBS J 2013; Labesse et al. Structure 2013.

